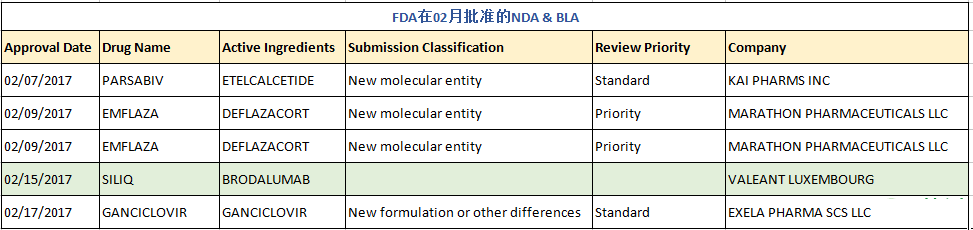
在剛過去的2月里,FDA共批準了4個新藥申請(NDA)、1個生物制品申請(BLA)及45個仿制藥申請(ANDA,不含6個預批準藥物),其中包括了5個首仿藥,后有詳細清單。
1
生物制品申請BLA
Siliq
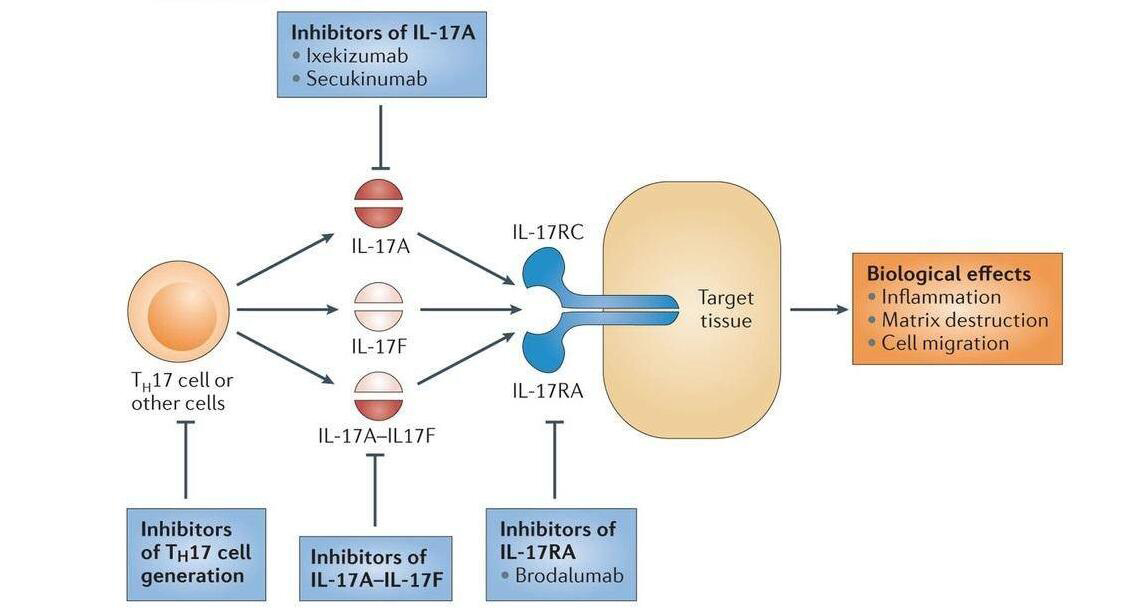
Siliq是由FDA于2017年02月15日批準的用于治療中度至重度斑塊性銀屑病的IL-17單抗藥物,活性成分為Brodalumab,批準規格為210mg/1.5ml,被批準公司為瓦蘭特(Valeant)制藥公司。這是第三款IL-17單抗抑制劑,也是一種新穎的IL-17受體的抑制劑。Brodalumab曾于2016年07月04日就已獲得日本醫藥品醫療器械綜合機構(PMDA)批準上市,被批準公司為日本協和發酵麒麟株式會社,商品名為Lumicef®。
白細胞介素17 (IL-17)在1993年首次被科研人員發現,隨后的研究發現IL-17在宿主防御、自身免疫性疾病發病以及腫瘤中發揮重要的作用。迄今為止,己有六個IL-17家族成員被發現:IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F,IL-17是IL-17家族的原型。Siliq的活性成分Brodalumab是一種新穎的IL-17受體的抑制劑(單克隆抗體),能選擇結合IL-17受體并阻止其與IL-17A、IL-17F及其它類型IL-17的結合,避免機體收到可能導致炎癥的信號,從而抑制銀屑病相關炎癥的應答反應。
Brodalumab最初由安進(Amgen)研發,后有臨床數據顯示Brodalumab與患者自殺傾向相關,于是放棄了Brodalumab這個一度曾被認為能“快速通過FDA審批和上市,并有望成為潛在的重磅產品”。之后阿斯利康(AstraZeneca)和日本協和發酵麒麟株式會社(Kyowa Hakko Kirin)獲得了該藥的研發授權。然而,在最后關頭AstraZeneca也不要Brodalumab,便與Valeant制藥公司達成合作,將Brodalumab的開發及商業化獨家權利授權給Valeant。因此,Valeant最終擁有Brodalumab除了日本及其他一些亞洲國家(這些地區由Kyowa Hakko Kirin持有)的開發及商業化的全球獨家權利。
Brodalumab是第三款IL-17抗體抑制劑。早在2015年01月15日,諾華(Novartis)就已分別獲得EMA和FDA批準的單抗新藥Secukinumab,是第一個上市的IL-17抑制劑。隨后,2016年03月22日禮來(Eli Lilly)獲得FDA批準的全球第二款IL-17A單抗抑制劑Ixekizumab,并于2016年04月25日獲得EMA的批準上市。因此,即使Brodalumab在斑塊狀銀屑病和銀屑病性關節炎兩個疾病治療方面表現出不俗的療效,預估獲批后也前景黯淡。而Valeant此次接盤Brodalumab,非常符合該公司賭徒一般的行事風格。
2
新化學藥NDA
PARSABIV
Parsabiv為FDA于2017年02月07日批準的用于治療血液透析慢性腎臟病(CKD)成年患者繼發性甲狀旁腺功能亢進(sHPT,簡稱繼發性甲旁亢),是一種擬鈣劑,活性成分為Etelcalcetide,是首個在每次透析結束時可通過靜脈注射給藥的擬鈣劑,批準規格為2.5mg/0.5ml、5mg/ml和10mg/2ml,被批準公司為KAI PHARMS INC(于2012年以3.15億美元被Amgen收購)。該產品曾于2016年08月被FDA否決,卻于2016年11月11日獲得歐洲藥品管理局(EMA)人用藥品委員會(CHMP)的批準上市(Amgen Europe B.V.),最終又于本月07日獲得FDA的批準。Parsabiv是安進(Amgen)公司第二個重磅級用于治療透析CKD患者的繼發性甲旁亢癥的藥物。
慢性腎臟病(CKD)是各種腎臟病于急性階段未經控制后的共同轉歸,近年來患病率有明顯上升趨勢,是全世界重要的公共健康問題。流行病學調查數據顯示,2011年美國成人CKD患病率已高達15.1%,我國目前CKD患病率為10.8%。透析患者的依從性和長期生存質量不高,每年透析死亡率仍高過20%。CKD長期透析死亡原因主要是慢性并發癥,其中繼發性甲旁亢又是早發、多發,危害大、治療難度大的一個并發癥,是CKD患者最常見且最嚴重的并發癥之一。
早在2004年03月,Amgen就已獲得FDA批準的重磅級用于治療透析CKD患者的繼發性甲旁亢的新藥SENSIPAR(普通口服片劑:30mg,60mg & 90mg),在2015年依舊獲得了逾14億美元的銷售額,但現在開始面臨仿制藥的競爭,SENSIPAR僅有大約25%的市場保護,主要與其依從性問題相關,該藥物需要每天服用。Parsabiv在透析期間輸注使用,從而回避了依從性問題。Parsabiv被預測可以與SENSIPA相媲美,甚至可能會超過SENSIPA,臨床試驗表明,Parsabiv用于繼發性甲狀旁腺機能亢進時在降低甲狀旁腺素水平方面與SENSIPAR一樣好,就經歷高水平響應的患者人數來說,它比SENSIPAR有效。
Parsabiv是Amgen公司SENSIPAR的后繼產品,去年公布的III期數據顯示,Parsabiv療效輕松擊敗SENSIPAR。Amgen研發執行副總裁Harper稱:“對于任何口服藥物,治療依從性都可能是一種挑戰,如果繼發性甲狀旁腺機能亢進控制不好,疾病可能會進展,并可能有重大臨床后果。通過使用Parsabiv,我們可以幫助確保這些患者獲得這一重要治療藥物,作為他們每周三次透析的一部分”。全球大約有200萬人因腎衰竭而進行透析,繼發性甲狀旁腺機能亢進是其一種頻繁的并發癥,分析師稱Parsabiv有巨大的銷售潛能。
EMFLAZA(老藥新用)
孤兒藥EMFLAZA為專注于罕見病新藥研發的美國馬拉松制藥公司Marathon Pharma于2017年02月09日獲得FDA批準的兩個制劑產品:片劑(四個規格6mg,18mg,30mg和36mg)和混懸劑(22.75mg/ml),活性成分為地夫可特(Deflazacort),用于治療5歲及以上杜氏肌營養不良癥(DMD,也稱假肥大性肌營養不良)患者。DMD是一個致命的兒童罕見病,因而Emflaza獲得了孤兒藥、優先審批、優先審批評審券等特殊待遇。
DMD是一種由編碼抗肌萎縮蛋白(dystrophy)基因突變所致的x-連鎖隱性遺傳性肌病,有約三分之一病例為散發,沒有家族史,是由基因突變造成。患者出生時多正常無異樣,自1歲以后開始逐漸出現站立和行走困難,到10歲時已不能行走、需要使用輪椅生活,大多數患兒最終臥床不起,并發痙攣、褥瘡、肺炎而在20歲前死亡。DMD一般為男孩發病,全世界活產男性新生嬰兒中的發病率約為1/3600,但是在極少數情況下,女孩也會得這種病。
Deflazacort是一個很老的糖皮質激素,其主要作用是腎上腺皮質機能減退、自身免疫性疾病、過敏性疾病及血液系統疾病等,常被用于過敏性疾病。很多國家都有廉價仿制產品(如我國浙江仙琚、天津天藥),但從未在美國上市。EMFLAZA是繼Exondys 51(由Sarepta公司于2016年09月19日獲批兩個規格口服液)后美國批準的第二個DMD藥物,FDA之所以批準Emflaza是基于20多年前做的一個研究:196名患者使用Emflaza肌肉力量有所改善。EMFLAZA只是緩解DMD患者癥狀,沒有亞型限制,因此Emflaza適用人群遠大于Exondys51(只適用13%患者)。“Emflaza是首款獲批用于治療廣大DMD患者的藥物,”FDA藥品評價與研究中心的神經病學產品部主任Billy Dunn博士說。“我們希望該治療選擇會使許多DMD患者獲益。”
GANCICLOVIR
GANCICLOVIR為FDA于2017年02月17日批準的用于免疫損傷引起巨細胞病毒感染的患者(如如艾滋病患者)的注射劑,活性成分為更昔洛韋(Ganciclovir)批準規格為2mg/ml,被批準公司為Exela制藥公司。
3
仿制藥
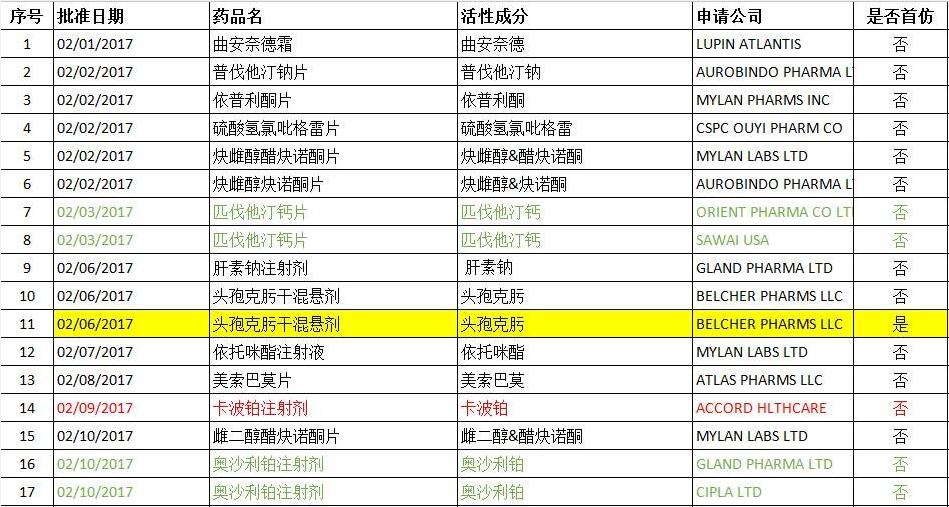
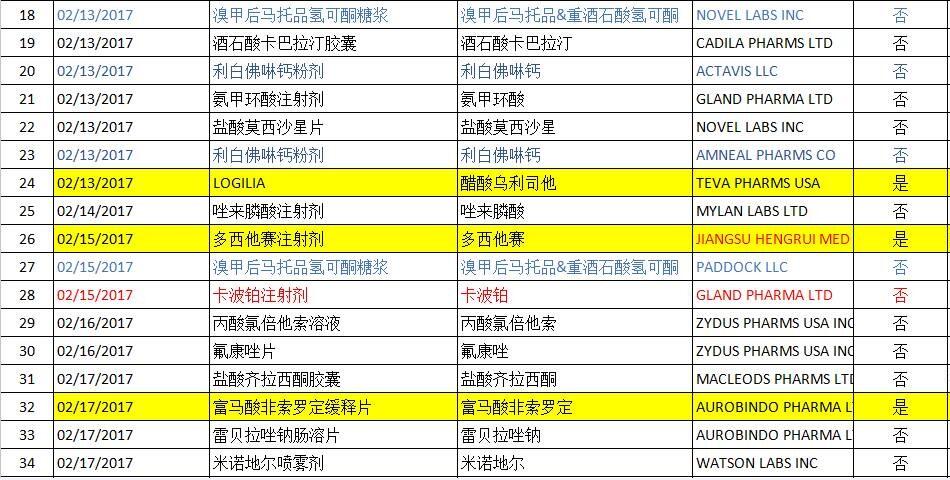
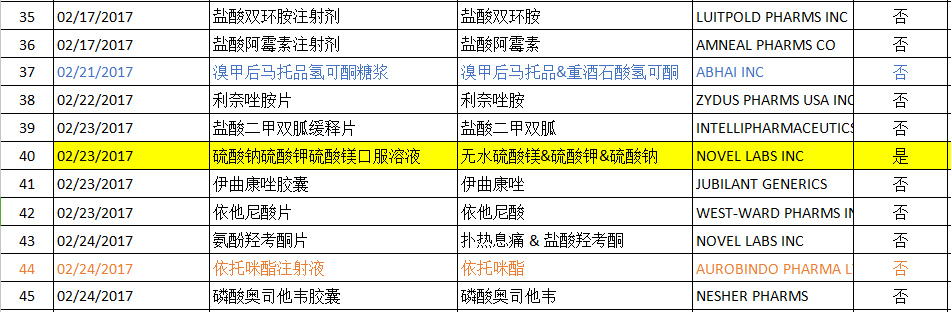
2017年02月FDA共批準ANDA藥物有45個(后面附詳細圖表),其中印度Aurobindo公司為大贏家,有5個產品獲得批準,其中1個為首仿產品;邁蘭(MYLAN)也有5個產品獲得批準(無首仿產品),數量與Aurobindo持平。溴甲后馬托品氫可酮糖漿獲得批準的公司最多,達到3個;利白佛啉鈣粉劑、奧沙利鉑注射劑、卡波鉑注射劑、匹伐他汀鈣片、依托咪酯注射液均有兩個公司獲得批準;其余產品均只有一個企業獲得批準。
CEFIXIME(頭孢克肟干混懸劑)
頭孢克肟為口服用的第三代頭孢菌素類抗生素,適用于治療敏感菌所致的呼吸、泌尿和膽道等部位的感染。本次Belcher公司獲得兩個頭孢克肟干混懸劑的批件,除了常規的100mg/5ml和200mg/5ml外,還獲得了500mg/5ml規格的批準,活性成分均為頭孢克肟(Cefixime)。Lupin公司于2013年02月首次獲得該規格的FDA批準文件,因此,對于500mg/5ml規格來說,Belcher的也算是首仿了。
LOGILIA(醋酸烏利司他片)
醋酸烏利司他是一種新型的緊急避孕藥,主要通過抑制或延遲排卵而發揮緊急避孕作用。與目前常用的緊急避孕藥左炔諾孕酮相比,醋酸烏利司不僅能在婦女無保護性交后長達120h內用藥,且緊急避孕效力不會隨用藥時間延遲而下降,同時安全性和耐受性均很好,因此它的臨床適用性更廣,具有能夠預防更多意外妊娠的潛力。醋酸烏利司他片的原研為HRA公司,商品名為ELLA,于2009年05月率先獲得EMA的批準,又2010年08月13日獲得FDA的批準,批準規格為30mg,Teva公司于本月13日首次仿制其30mg產品,并于當日獲得FDA專利申請。
DOCETAXEL(多西他賽注射劑)
多西他賽(Docetaxel,也叫多西紫杉醇)屬于紫杉類化合物抗腫瘤藥中的一種,主要治療晚期乳腺癌、卵巢癌、非小細胞肺癌,對頭頸部癌、小細胞肺癌;對胃癌、胰腺癌、黑色素瘤等也有一定療效。Taxotere(多西他賽注射劑)于1995年在首次墨西哥上市,原研公司為Aventis(安萬特,2004年被賽諾菲收購),1995年11月獲得EMA的批準上市,1996年05月獲得FDA的批準上市,到現在為止已在英、美、法、意、德、日等主要國家上市,并有多種規格。隨后,Sandoz、Pfizer等7個公司陸續開發多個新規格并上市,Teva、DR REDDYS和DFB分別仿制了其中的幾個規格,江蘇恒瑞醫藥于2017年02月15日首次仿制其中的40mg/ml注射劑。
FESOTERODINEFUMARATE(富馬酸非索羅定緩釋片)
富馬酸非索羅定是一個治療膀胱過度活動綜合征的前體藥物,進入體內后轉換為一個毒蕈堿受體拮抗劑的活性代謝物5-HMT,可用于膀胱過度活動癥(OAB)患者尿頻、尿急、尿失禁或所有這些癥狀組合的治療。富馬酸非索羅定緩釋片的原研公司為輝瑞(Pfizer),商品名為Toviaz,于2007年04月20日獲得EMA的批準上市,于2008年10月31日獲得FDA的批準上市,批準規格為4mg & 8mg。可能因專利問題,早在2015年04月末至05月初,就有Alembic、Lupin、Sun等8家公司先于獲得預批準(但直到現在還未上市),而本次AUROBINDO公司獲得批準的同時獲得FDA專利的申請批準。
SODIUMSULFATE, POTASSIUM SULFATE AND MAGNESIUM SULFATE(硫酸鈉硫酸鉀硫酸鎂口服溶液)
電子結腸鏡現已成為大腸疾病診斷和治療的重要方法之一,腸鏡檢查能否順利完成,術前腸道準備起著關鍵的作用。高質量的腸道準備是腸鏡下視野清晰的必要條件,能夠大大降低漏診率和不必要的重復檢查。目前常用的方法有口服藥物法和灌腸法。由于臨床上單獨使用灌腸法仍無法滿足結腸鏡檢查的要求,所以用得最多的是口服藥物法(灌腸法一般僅用于不能口服瀉藥或口服瀉藥失敗后的補救措施)。目前國內常用的口服藥物有聚乙二醇電解質(聚乙二醇4000(60g)、無水硫酸鈉、氯化鈉、氯化鉀、碳酸氫鈉)、硫酸鎂、磷酸鈉鹽、番瀉葉、甘露醇等。硫酸鈉硫酸鉀硫酸鎂口服溶液主要用于進行結腸鏡檢查成人患者的腸道內容物清除,原研公司為Braintree Labs,商品名為SUPREP BOWEL PREP KIT,于2010年08月05日獲得FDA的批準上市。本次NOVEL LABS INC于2017年02月23日獲得FDA批準的首仿制劑。
4
ANDA批準清單
注:因信息量較大,內容難免有差錯,北京凱瑞科德真誠期待各位同行的交流與探討、批評與建議。謝謝!