


1. 定義
ANDA(Abbreviated New Drug Application)仿制藥申請,美國的藥品申請一般分為三大類型,即創新藥物及其制劑的申請(NDA),仿制藥的申請(ANDA)和OTC(非處方藥)的申請,仿制藥申請被稱為‘簡短的’(abbreviated),是因為這類申請不需要提供臨床前(動物)和臨床(人體)數據來證明其安全性和有效性。取而代之的是,仿制藥申請者必需提供產品生物等效性的證明材料(比如與原研藥相比沒有區別)。一旦此類藥品獲得批準,申請者可以生產并上市這一安全有效且價格低廉的替代物。
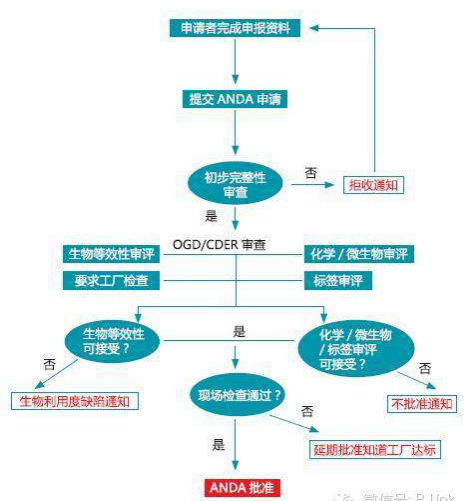
2. 美國ANDA制劑審批流程
3. 我們的服務:
3.1 處方研發
具備完善的處方研發團隊,先進的實驗儀器,多次ANDA研發注冊經驗,可以為廠家提供技術指導或幫助廠家進行處方研發,方法驗證等藥學研究。
3.2 BE實驗安排
三批注冊批生產完成后,若三個月穩定性資料符合標準,即可進行BE(生物等效性)實驗,由于在國內進行BE實驗費用較高,我方可安排印度的BE公司進行實驗,包括跟進BE證書的申請、寄送藥品、溝通試驗進度、進行BE監控等業務。
3.3 ANDA號申請
若BE實驗通過,可進行ANDA的申報工作,我方可負責ANDA號的申請。
3.4 ANDA申請資料撰寫
申請資料分為M1、M2、M3、M5四部分,由研發部門或廠家提供相關信息(行政信息,研發資料,注冊批資料等),我方可翻譯編輯注冊資料的eCTD格式,并通過ESG通道遞交給FDA。
3.5 回復信的編輯及遞交
FDA針對該申請文件進行審查后,會給出回復信(如Information Request),我方可針對回復信問題對廠家進行指導,并編輯文件資料的eCTD格式進行缺陷回復,直到拿到ANDA注冊號。
微信掃一掃
